|
Интегроны, мобилизующие мир бактерий на новые "достижения" |
|
Бум научных публикаций в течение 25 лет
сопровождает изучение природных векторов клонирования и экспрессии генов
бактерий — интегронов. Сегодня в англоязычном Интернете существует более
1800 электронных документов по ключевой фразе «class 1 integron» (впрочем, в
русскоязычном сегменте можно обнаружить не более 75 ссылок).
В исследовании биологической роли интегронов объединились специалисты в
области природоведческой и клинической микробиологии, что случается далеко
не всегда. Первооткрыватели интегронов — австралийские микробиологи — с
помощью полимеразной цепной реакции в реальном времени показали, что такие
генные структуры нередки в окружающей среде: в водных осадках до 3% клеток
бактерий содержат интегроны 1-го класса. В клинике же число позитивных
культур может достигать 50-60%, медицинскими учреждениями риска являются
перинатальные центры (которые сейчас интенсивно открываются), отделения
трансплантации (там, где пациенты получают иммуносупрессанты) и экстренной
помощи. «Госпитальные» интегроны различаются по составу генных кассет —
особо устроенных генов, кодирующих устойчивость к антимикробным соединениям.
Уровень экспрессии генной кассеты, включенной в интегрон (т.е. активность ее
продукта — фермента, контактирующего с антибиотиком) определяется силой
промотора. По аналогии — это громкость звучания, например, аудиокассеты,
однако «убавить» звук в случае интегрона чрезвычайно сложно (по крайней мере
пока).
Вклад интегронов в развитие антибиотикорезистентности убедительно показан на
примере сульфамидной терапии. Таковая стала возможна в начале сороковых
годов прошлого века (в нашей стране благодаря работам академика И.Я.
Постовского, когда в Свердловске было освоено производство сульфидина).
Результат применения (во многом нерационального) препаратов сульфамидного
ряда оказался вполне предсказуемым: сегодня на обширнейшей территории гены
устойчивости к сульфамидам выявляются в составе интегронов не только у
клинических, но и природных штаммов.
Работы по исследованию циркулирующих интегронов начались в Институте
экологии и генетики микроорганизмов УрО РАН одними из первых в стране и уже
получены убедительные доказательства наличия генетически неотличимых
структур у бактерий географически удаленных территорий. Так, любопытным
оказался интегрон культуры Acinetobacter, выделенной в 2003 году в Перми и
очень близкой по физиологии к природным штаммам из-за слабого роста при
повышенной температуре, например, в очаге воспаления. Такой интегрон в
течение 20 лет циркулирует среди кишечных бактерий Европы, Юго-Восточной
Азии и Центральной Африки, состоит из двух генных кассет: dfrA5 и ereA2
(кодируют устойчивость к триметоприму и эритромицину) и, как мы видим,
способен преодолевать межвидовые барьеры. Детальный («побуквенный»)
генетический анализ показал, что мы имеем дело со стабильной структурой,
сложившейся, по-видимому, не так давно — синтетический ингибитор синтеза
фолиевой кислоты триметоприм применяется лишь 50 лет. Нами обнаружены еще
два «интернациональных» интегрона и, пользуясь, накопленным в институте
серьезным опытом изучения процессов микробного мутагенеза, показано, что
мутации в интегронах реально происходят в области промоторов. Причем именно
ацинетобактер является одной из наиболее удобных моделей изучения
мутационного процесса: не случайно для генетических экспериментов с
культурой Acinetobacter baumannii коллеги из Малайзии задействовали борт
российского сегмента Международной космической станции. Одна из важнейших
задач в исследованиях подобного рода — прогноз в отношении будущих
возбудителей инфекций человека в высокотехнологичных медицинских стационарах
при использовании самых активных антибиотиков. Опыт показывает, что
патогенные формы могут быть рекрутированы из числа привычных сапрофитных
бактерий, но при наличии эффективно экспрессируемой лекарственной
устойчивости. Уже известно, что почвенный родококк может быть резистентен к
ванкомицину — препарату, зарезервированному в клинике, как крайнее средство
при грамположительном «заражении крови». Поэтому необходимо контролировать
появление новых мобильных резистентных генов в интегронах: похоже, именно
так «создаются» штаммы с лекарственной сверхустойчивостью. Впрочем, мы уже
имеем в руках надежные методы мониторинга: в большинстве случаев достаточно
1–2 бактериальных колоний размером в пол-миллиметра, а выделить пригодную
ДНК в состоянии практически любая бактериологическая лаборатория.
Впрочем, роль интегронов может быть и позитивной, например, при создании
ценных модифицированных штаммов. Ген, встроенный в интегронную платформу,
под контролем сильного промотора способен дать (исходя из уровня экспрессии)
в 15–20 раз больше целевого продукта. Однако перспектива использования
интегрон-позитивных штаммов в биотехнологических процессах ставит новые
вопросы в изучении стабильности и биобезопасности этих бактериальных
векторов.
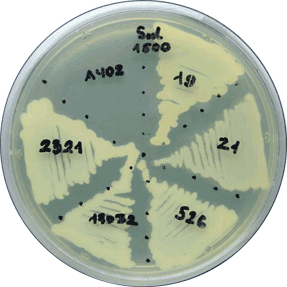
На иллюстрации:
ацинетобактер весьма подвержен генетическим модификациям:
интегрон-позитивные штаммы легко растут при граммовых концентрациях
сульфамидов.
|
|
НАУКА УРАЛА Газета Уральского отделения Российской академии наук Январь 2009 г. № 2-3 (987) |