 Недавно ученые Института клеточного и внутриклеточного симбиоза УрО РАН (г. Оренбург) подали заявку на патентование способа оценки тяжести течения сепсиса — опаснейшего инфекционного заболевания, развивающегося при прогрессировании и распространении инфекционного процесса по организму через кровь. Актуальность проблем диагностики и лечения сепсиса очевидна. Неслучайно в течение двадцати лет определение этой патологии трижды менялось и уточнялось (последний раз в 2016 г.), создано и эффективно работает международное сообщество Surviving Sepsis Campaign, основная задача которого — разработка, оптимизация и внедрение в клиническую практику современных достижений медицины, помогающих бороться с сепсисом.
Недавно ученые Института клеточного и внутриклеточного симбиоза УрО РАН (г. Оренбург) подали заявку на патентование способа оценки тяжести течения сепсиса — опаснейшего инфекционного заболевания, развивающегося при прогрессировании и распространении инфекционного процесса по организму через кровь. Актуальность проблем диагностики и лечения сепсиса очевидна. Неслучайно в течение двадцати лет определение этой патологии трижды менялось и уточнялось (последний раз в 2016 г.), создано и эффективно работает международное сообщество Surviving Sepsis Campaign, основная задача которого — разработка, оптимизация и внедрение в клиническую практику современных достижений медицины, помогающих бороться с сепсисом.
Новый способ определения тяжести течения заболевания по количеству бактерий, находящихся на поверхности и внутри эритроцитов крови, разработала старший научный сотрудник лаборатории экологии микроорганизмов ИКВС УрО РАН кандидат биологических наук Е.А. Щуплова. Этому предшествовали многолетние исследования взаимодействия микроорганизмов и эритроцитов.
После окончания биологического факультета Оренбургского педагогического университета Елена Щуплова в течение десяти лет преподавала в Оренбургском медицинском университете. В Институт клеточного и внутриклеточного симбиоза УрО РАН она пришла в 2001 г., поступила в аспирантуру, защитила кандидатскую диссертацию, продолжив преподавание. Однако научная работа занимала ее все больше и больше. Исследовать гемолитическую активность микроорганизмов (вызывающую разрушение эритроцитов крови) Елене Алексеевне предложил ее научный руководитель доктор медицинских наук Борис Яковлевич Усвяцов. Когда она впервые озвучила эту тему на заседании институтского ученого совета, его члены отнеслись к ней скептически: мол, все это давно изучено, ничего нового не узнать. Тем не менее Елена Щуплова продолжила исследования. Начав с освоения существующих методик, она разработала новые методические подходы, позволившие иначе взглянуть на, казалось бы, известный биологический феномен. В 2015 г. ее доклад по проблеме взаимодействия возбудителей гнойно-воспалительных заболеваний с эритроцитами человека занял первое место в секции микробиологии на Пермском научном форуме УрО РАН. А в июле нынешнего года мы подробно поговорили с Еленой Алексеевной о ее работе.
— Вы изучаете взаимодействие микроорганизмов с эритроцитами. В чем оно заключается?
— Это взаимодействие может протекать по-разному. При наличии у бактерий определенного спектра биологических свойств, включая гемолитическую активность, происходит разрушение эритроцитов, т.е. их лизис. Увидеть мы это можем с помощью экспериментов на пятипроцентном кровяном агаре — это питательная среда для микробов, куда добавляется эритроцитарная взвесь. На кровяной агар сеют микробов, и вскоре в нем появляется прозрачный участок — зона гемолиза, то есть разрушения эритроцитов. Но возможен и другой вариант, когда бактерии, не нарушая клеточную стенку эритроцита, проникают внутрь него. В любом случае микробы получают доступ к гемоглобину.
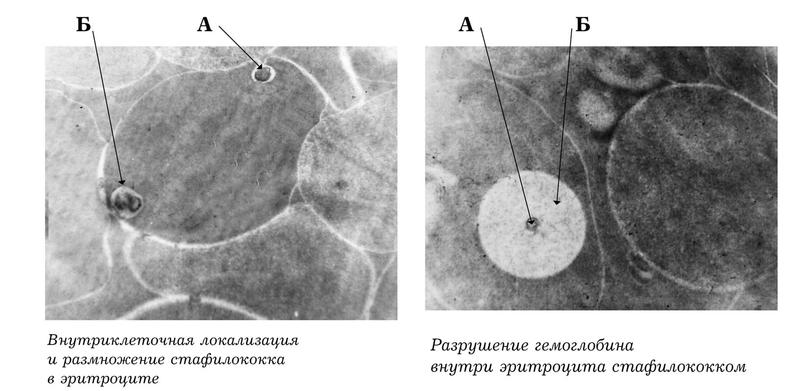 |
Взаимодействие бактерий с эритроцитами мы исследуем с использованием как электронной микроскопии (см. вверху), так и еще более точного метода — конфокальной лазерной сканирующей микроскопии (см. фото внизу). Эти взаимодействия очень сложны, тут могут быть активными обе стороны. Есть данные в пользу того, что эритроциты, выполняя роль антигенпрезентирующих клеток (это клетки, которые прикрепляют к своей поверхности чужеродные антигены — бактерии, вирусы и т.д.), сами участвуют в захвате бактерий, образуя в крови циркулирующие иммунные комплексы, а затем переносят их к клеткам иммунной системы, чтобы те могли их уничтожить. Таким образом, эритроциты наряду с макрофагами выполняют защитную функцию.
|
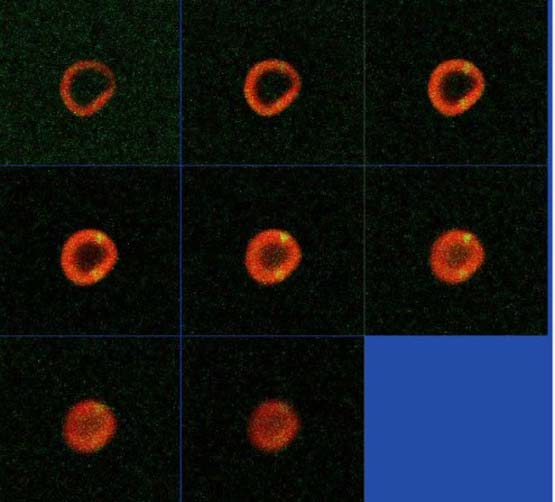
Последовательное изображение эритроцита, внутри которого располагается стафилококк, полученное с помощью конфокальной лазерной сканирующей микроскопии
|
— Что такое антигемоглобиновая активность эритроцитов?
— Эритроциты на 90% состоят из гемоглобина, который может существовать в различных формах: оксигемоглобина, карбогемоглобина, карбоксигемоглобина, метгемоглобина и др. Оксигемоглобин выполняет важнейшую функцию переноса кислорода к тканям организма. Карбоксигемоглобин представляет собой прочное соединение гемоглобина и угарного газа, его избыток в крови приводит к кислородному голоданию, так как угарный газ лишает гемоглобин способности присоединять к себе кислород. Метгемоглобин — это окисленная форма гемоглобина, при которой атомы двухвалентного железа окисляются до трехвалентного. Метгемоглобин также неспособен соединяться с молекулами кислорода и переносить его к органам и тканям, в результате чего наступает гипоксия, т.е. понижается содержание кислорода в тканях организма. Кстати, гипоксия — одно из тяжелейших осложнений сепсиса.
Свойство бактерий проникать внутрь эритроцитов и менять структуру гемоглобина было названо антигемоглобиновой активностью микроорганизмов. На способ ее количественного определения мы получили патент. В дальнейшем в экспериментах in vitro (в пробирках) мы показали, что микроорганизмы способны окислять гемоглобин, превращая его в метгемоглобин. Полученные результаты нашли подтверждения в литературе.
— А зачем бактериям гемоглобин?
— Во-первых, для утилизации железа, которое они используют для собственного метаболизма, для роста и размножения. У микроорганизмов есть специальные механизмы захвата железа с помощью сидерофор — синтезируемых бактериями химических соединений, которые связывают железо.
Есть еще одна гипотеза относительно того, зачем микробы проникают в эритроциты. Они делают это, чтобы временно «укрыться» от иммунной системы макроорганизма. Внутри эритроцита иммунные клетки «не видят» патогенный микроорганизм, который они призваны уничтожить. А при ослаблении иммунитета микробы могут снова выходить в кровоток. Вероятно, таким же образом они пытаются «спрятаться» и от антибиотиков. Взаимодействие эритроцитов с бактериями под действием антибиотиков еще предстоит изучить. Пока мы исследуем это in vitro, но планируем провести экcперименты in vivo (на лабораторных животных), а потом можно будет подумать, как использовать эти результаты на практике. Ведь если бактерии способны укрываться от антибиотиков внутри эритроцитов, то эффективность лечения существенно снижается. В итоге острый инфекционный процесс может принять черты хронического и будет сопровождаться анемией.
Мы проследили интересную зависимость: у детей, у которых развивается инфекционный процесс (например, есть фурункулы, абсцессы или карбункулы), уровень гемоглобина в крови понижается, поскольку патогенные микроорганизмы его разрушают, а после лечения основного заболевания уровень гемоглобина повышается сам собой без применения железосодержащих препаратов. А вот обратной зависимости мы не обнаружили: изучая микрофлору зева и носовой полости детей с анемией, мы не выявили бактерий с высоким уровнем антигемоглобиновой активности; анемия у них другой этиологии, и инфекций может и не быть. На способ прогнозирования развития анемии при гнойно-воспалительных заболеваниях мы получили патент.
— Таким образом, от фундаментальных вопросов мы переходим к клинической практике. Насколько ваши исследования актуальны по отношению к сепсису?
— Классический бактериологический метод диагностики сепсиса — выделение гемокультуры из образца крови больного, но он срабатывает только в 40–50% случаев. Кроме того, этот метод не быстрый. Надо взять образец крови, посеять и ждать результата 5–7 дней. А за это время пациент может погибнуть, ведь сепсис часто развивается молниеносно, даже в течение суток. Поэтому сейчас используются методы экспресс-диагностики. Один из них — молекулярно-генетический метод FISH (флуоресцентная in situ гибридизация). В данном случае не нужно выделять гемокультуру, можно сразу работать с клиническим материалом — образцами крови.
Мы придумали способ подготовки эритроцитов для экспресс-диагностики сепсиса, используя метод FISH. Для того чтобы сработал ДНК-зонд, требуется температура 600. Необходимо создать такие условия для эритроцитов, чтобы при достаточно высокой температуре во время гибридизации они сохраняли свою структуру и не нарушалась их мембрана. Тогда мы сможем обнаружить микробы на поверхности и внутри эритроцитов, и по их количеству судить о тяжести течения заболевания. На данный способ мы также получили патент на изобретение.
Для оценки тяжести состояния больных сепсисом и исхода болезни разработаны различные шкалы, которые включают клинические и лабораторные показатели крови пациентов. Часто они громоздки и неудобны, поэтому врачи обычно пользуются сокращенными формулами прогнозирования, включающими 4–5 критериев. В последнее время для ранней диагностики сепсиса используют специфические белки — биомаркеры. Известно около 200 биомаркеров сепсиса, однако лишь немногие из них находят клиническое применение. Один из таких биомаркеров — прокальцитонин. Это вещество, которое при отсутствии бактериального заражения вырабатывается в щитовидной железе и сразу превращается в кальцитонин, не поступая в кровь. При сепсисе прокальцитонин синтезируется и другими органами — печенью, почками, а также мышцами. Вещество попадает в кровь, и его уровень значительно повышается, поэтому прокальцитонин является очень точным биомаркером сепсиса, причем бактериальной природы, а не вирусной. Но если у пациента нарушены обменные процессы, есть заболевания щитовидной железы или онкология, уровень прокальцитонина в крови всегда будет высоким, независимо от того, развивается сепсис или нет. Недостаток этого биомаркера заключается и в том, что он не позволяет судить о тяжести состояния пациента, эффективности лечения и исходе болезни. Поэтому для постановки точного диагноза и оценки тяжести состояния больных сепсисом необходимо проводить современные молекулярно-генетические, бактериологические исследования.
Мы применили метод FISH, который оказался достаточно чувствительным при диагностике сепсиса. С его помощью мы можем не только обнаружить бактерии в крови, но и сразу узнать, какой это микроб, т.е. провести идентификацию. Благодаря этому методу в комплексе с клиническими и биохимическими показателями крови пациентов можно повысить точность ранней диагностики, а по количеству бактерий, прикрепившихся к поверхности эритроцитов и локализованных внутри них, определить тяжесть заболевания, что поспособствует своевременному назначению антибактериальной терапии. Данный способ гораздо дешевле и проще, чем ПЦР-анализ гемокультуры и другие методы.
Недавно Елена Щуплова вместе с коллегами из Института клеточного и внутриклеточного симбиоза УрО РАН получила Свидетельство о государственной регистрации программы для ЭВМ, предназначенной для дифференциации степени тяжести сепсиса на основе выявления бактерий в образцах крови больных. Оренбургские микробиологи продолжают исследования, потому что остается еще множество вопросов, на которые нужно найти ответы.
Е. Понизовкина
На заглавном фото: Е.А. Щуплова с врио заведующего лабораторией экологии микроорганизмов доктором медицинских наук С.Б. Фадеевым и кандидатом медицинских наук К.Л. Чертковым.


 Ru | En
Ru | En



 Ru | En
Ru | En

 Недавно ученые Института клеточного и внутриклеточного симбиоза УрО РАН (г. Оренбург) подали заявку на патентование способа оценки тяжести течения сепсиса — опаснейшего инфекционного заболевания, развивающегося при прогрессировании и распространении инфекционного процесса по организму через кровь. Актуальность проблем диагностики и лечения сепсиса очевидна. Неслучайно в течение двадцати лет определение этой патологии трижды менялось и уточнялось (последний раз в 2016 г.), создано и эффективно работает международное сообщество Surviving Sepsis Campaign, основная задача которого — разработка, оптимизация и внедрение в клиническую практику современных достижений медицины, помогающих бороться с сепсисом.
Недавно ученые Института клеточного и внутриклеточного симбиоза УрО РАН (г. Оренбург) подали заявку на патентование способа оценки тяжести течения сепсиса — опаснейшего инфекционного заболевания, развивающегося при прогрессировании и распространении инфекционного процесса по организму через кровь. Актуальность проблем диагностики и лечения сепсиса очевидна. Неслучайно в течение двадцати лет определение этой патологии трижды менялось и уточнялось (последний раз в 2016 г.), создано и эффективно работает международное сообщество Surviving Sepsis Campaign, основная задача которого — разработка, оптимизация и внедрение в клиническую практику современных достижений медицины, помогающих бороться с сепсисом.